石仙桃多糖提取工艺优化及含量测定
石仙桃多糖提取工艺优化及含量测定
陈龙,黎美秀,樊柳园,李鹏,李平凤
(广西中医药大学,南宁 530200)摘 要: 目的 优化石仙桃多糖提取工艺并对其进行含量测定。方法 采用紫外-可见分光光度法测定石仙桃多糖含量,以D-无水葡萄糖标准品为对照,检测波长为485nm。通过单因素考察和正交实验确定石仙桃最佳的提取工艺并测定其含量。结果 采用回流提取法提取石仙桃多糖,确定最佳提取工艺为:粉碎粒度65目,料液比1:80,提取时间3h,在此条件下测得不同产地石仙桃多糖含量在3.22%~8.03%之间。结论 该方法结果准确、可靠,可用为石仙桃多糖的提取方法,为石仙桃的质量控制提供一定的实验数据。
关键词:石仙桃;多糖;含量测定
The process optimization and determination of polysaccharide concent in Pholidota Chinensis Lindl.
CHEN Long, LI Meixiu, FAN Liuyuan, LI Peng, LI Pingfeng
(Guangxi University of Chinese Medicine, Nanning 530200)
Abstract: Objective To optimize the extraction technology of polysaccharide and to determine the content of Pholidota Chinensis Lindl. Methods Using the UV visible spectrophotometry to determine the polysaccharide content of Pholidota Chinensis Lindl. Compared with the standard of D- anhydrous glucose, the detection wavelength was 485nm. Through single factor and orthogonal experiment to determine the optimum extraction process of Pholidota Chinensis Lindl. and its content determination. Results the reflux extraction polysaccharide, the optimal extraction process was: particle size of 65 mesh, solid-liquid ratio 1:80, extraction time 3h, then measured under the condition of different origin polysaccharide content between 3.22%~8.03%. Conclusion The method is accurate and reliable, can be used for the extraction of polysaccharide, provide some experimental data for the quality control of Pholidota Chinensis Lindl.
Keywords: Pholidota Chinensis Lindl; Polysaccharide; Content determination
石仙桃(Pholidota Chinensis Lindl)为兰科石仙桃属植物石仙桃假鳞茎或全草,又名石上莲、石橄榄、石穿盘、石萸肉等[1]石仙桃具有养阴、清肺、利湿、消瘀的作用,可治疗眩晕、头痛、咳嗽、吐血、梦遗、痢疾、白带、疳积,民间常用来治疗高血压及其他原因引起的头痛[2-3]。研究表明石仙桃含有多糖、生物碱、三萜类、菲醌、联苯、9,10-二氢菲类、二苯乙烯类等[4-5]。现代药理表明石仙桃具有镇静、抗氧化、抗癌、对神经系统有抑制作用,尤其是提取物制成的头痛定糖浆治疗神经性头痛总有效率90%[6-8]。其中植物多糖具有包括机体免疫调节、抗肿瘤、降血糖、降血脂、抑制肿瘤、抗辐射、抗衰老、抗菌、抗病毒、保护肝脏等多种生物活性[9]。石仙桃应用广泛,逐渐引起人们的重视。近年来,科研工作者对其进行了一定的研究,但是对其多糖的提取工艺与含量测定几乎未见报道[10],所以希望通过本次实验能对以后石仙桃更加深入的研究带来一定的帮助。
2 石仙桃多糖的含量测定
2.1 仪器、试剂与药材
电热鼓风干燥箱(上海一恒科学实验仪器有限公司);高速万能粉碎机(天津市泰斯特仪器有限公司);SQP电子天平(赛多利科学仪器(北京)有限公司);HH-S6数显恒温水浴锅(金坛市医疗仪器厂);红外炉(美的);UV-1780紫外-可见光分光光度计(岛津企业管理(中国)有限公司);KQ5200B型超声波清洗器(昆山市超声仪器有限公司);纯水仪(美国密理博 Milli-Q Advantage A10 超纯水系统);药典筛子。
无水乙醇、苯酚、浓硫酸(均为分析纯,国药集团化学试剂有限公司);水为超纯水。
D-无水葡萄糖对照品(中国食品药品检定研究院,批号:110833-201204)。
实验用石仙桃药材采自广西、广东及福建,样品原植物采集后经广西中医药大学药用植物园高级园艺师朱意麟鉴定为兰科石仙桃属植物石仙桃(Pholidota Chinensis Lindl.)的全草。药材来源信息见表1。采集到的药材水焯5min,45℃烘干,切段干燥,打粉过2号筛备用。
表1石仙桃药材来源信息表
| 编号 | 采集时间 | 采集地点 | 药用部位 | 样品状态 |
| SXT-1 | 2016.3.24 | 广西来宾市金秀县圣堂山 | 全草 | 药材 |
| SXT-2 | 2016.3.25 | 广西来宾市金秀县莲花山 | 全草 | 药材 |
| SXT-3 | 2016.3.15 | 广西防城港市防城区 | 全草 | 药材 |
| SXT-4 | 2016.3.28 | 广西防城港市防城区 | 全草 | 药材 |
| SXT-5 | 2016.3.29 | 广西防城港市防城区 | 全草 | 药材 |
| SXT-6 | 2016.3.10 | 广西桂林市平乐县 | 全草 | 药材 |
| SXT-7 | 2016.6.25 | 广东韶关市翁源县 | 全草 | 药材 |
| SXT-8 | 2016.6.30 | 福建宁德古田县 | 全草 | 药材 |
| SXT-9 | 2016.7.8 | 福建省漳州市漳浦县 | 全草 | 药材 |
| SXT-10 | 2016.7.13 | 广西南宁市钦北区 | 全草 | 药材 |
| SXT-11 | 2016.7.28 | 广西来宾市金秀县圣堂山 | 全草 | 药材 |
| SXT-12 | 2016.7.30 | 广西防城港市防城区 | 全草 | 药材 |
| SXT-13 | 2016.8.26 | 广西桂林市平乐县 | 全草 | 药材 |
| SXT-14 | 2016.10.22 | 广西河池市天峨县 | 全草 | 药材 |
| SXT-15 | 2016.11.17 | 广西来宾市金秀县 | 全草 | 药材 |
| SXT-16 | 2017.1.3 | 广西来宾市金秀县 | 全草 | 药材 |
2.2 方法与结果
2.2.1 样品制备
2.2.1.1 对照品溶液的制备
取D-无水葡萄糖标准品适量,精密称定,加蒸馏水制成90ug·ml-1的对照品溶液。
2.2.1.2 供试品溶液制备
取SXT-12药材粉末0.3g,精密称定,置锥形瓶中,加蒸馏水80ml,称重,加热回流2h,冷却并补重,过滤,取续滤液1ml至10ml离心管,精密加入无水乙醇5ml,摇匀,冷藏4h,离心20min(4000r·min-1),弃去上清液,挥干溶剂,沉淀加80%乙醇洗涤两次,每次5ml,离心10min(4000r·min-1),沉淀加热水溶解,转移至2ml容量瓶中,加水至刻度,既得。
2.2.2 显色方法[10-11]
硫酸-苯酚显色法。精密量取供试品溶液1ml,置10ml具塞试管中,加新配置的5%苯酚溶液1ml,摇匀,迅速加浓硫酸5ml,摇匀,沸水浴加热20min后置冰水冷却5min,最大吸收波长处测定吸光度值。
2.2.3 最大吸收波长选择
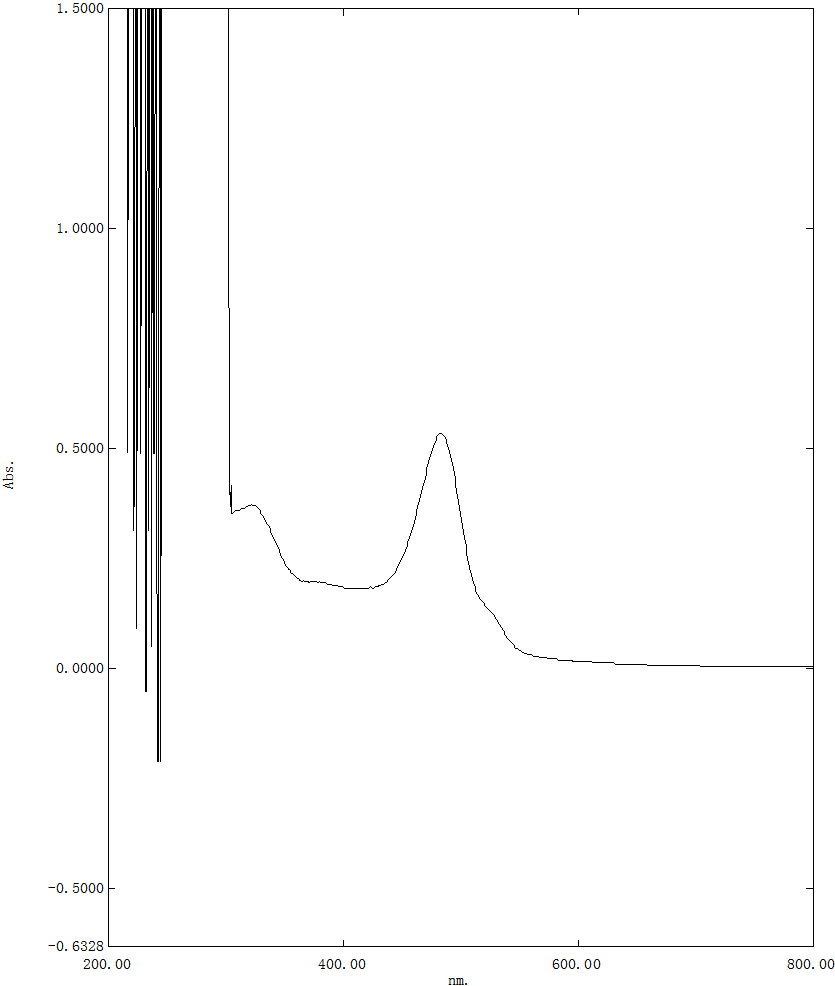
分别取对照品溶液、供试品溶液0.5ml和1.0ml置10ml具塞试管,加水补至1ml,加新配置的5%苯酚溶液1ml,摇匀,沿管壁迅速加浓硫酸5ml,摇匀,沸水浴加热20min后置冰水冷却5min,紫外可见光全波长扫描,确定最大吸收波长485nm。见图1。
 |
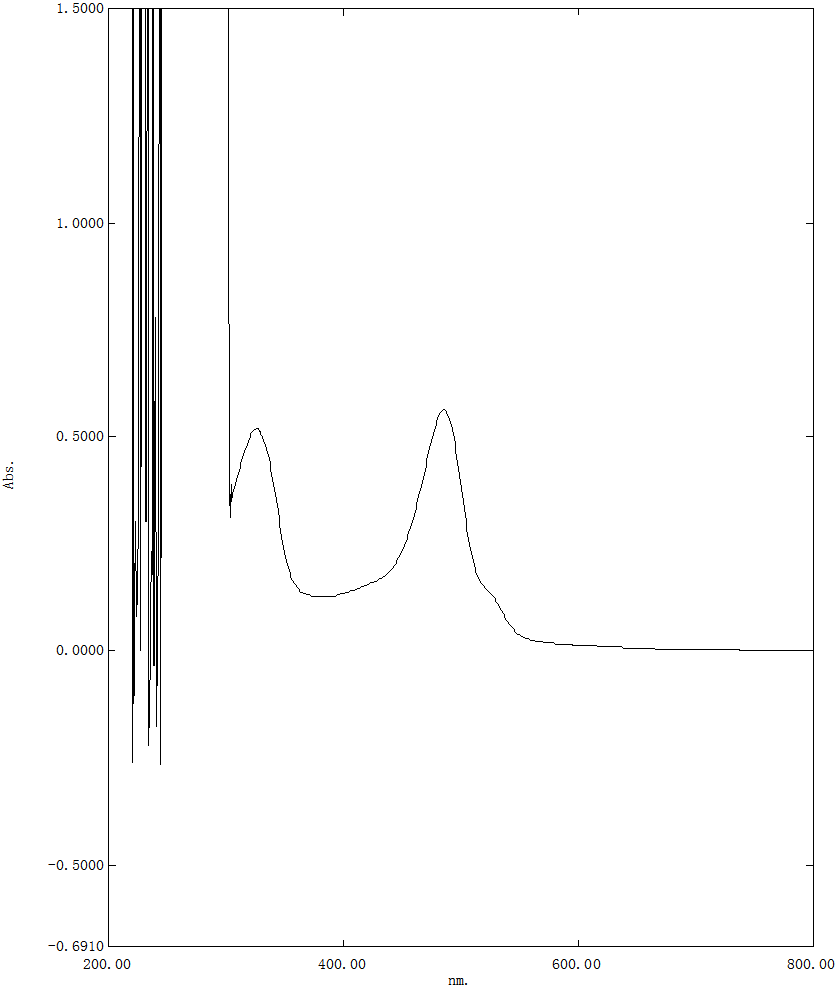 |
图1 紫外可见光全波长扫描图谱
A:对照品溶液 B:样品溶液
2.2.4 标准曲线的制备
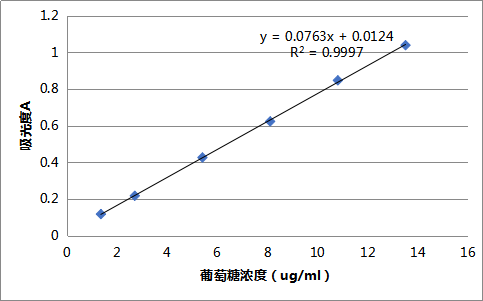
分别取“2.2.1.1”项下对照品母液0.1、0.2、0.4、0.6、0.8、1.0ml置10ml具塞试管,加水补至1ml,加新配置的5%苯酚溶液1ml,摇匀,迅速加浓硫酸5ml,摇匀,沸水浴加热20min后置冰水冷却5min,485nm测定吸光度值,结果见表2、图2。
表2 葡萄糖标准溶液线性关系考察
| 序号 | 1 | 2 | 3 | 4 | 5 | 6 |
| C( ug·ml) | 1.351 | 2.703 | 5.406 | 8.109 | 10.811 | 13.514 |
| A | 0.117 | 0.217 | 0.426 | 0.623 | 0.847 | 1.039 |
 |
2.2.5 石仙桃多糖提取工艺优化
2.2.5.1 提取方法考察
分别取SXT-12药材粉末0.3g,精密称定,加蒸馏水80ml,采用冷浸法(24h)、热浸法(12h;80℃)、超声提取法(2h)、回流提取法(2h)等方法对石仙桃多糖进行提取,并按供试品溶液制备方法项下的方法对提取溶液进行处理,按显色方法项下方法进行显色,紫外分光光度计测定吸光度值。结果显示采用回流提取法,石仙桃多糖提取率最高,故选用回流提取法提取石仙桃多糖。见表3。
表3提取方法考察
| 提取方法 | 含量(%) | 平均含量(%) | RSD(%) |
| 冷浸法 | 0.51 | 0.52 | 0.95 |
| 0.52 | |||
| 0.52 | |||
| 热浸法 | 0.97 | 0.97 | 0.09 |
| 0.97 | |||
| 0.97 | |||
| 超声提取法 | 0.74 | 0.74 | 2.44 |
| 0.72 | |||
| 0.76 | |||
| 回流提取法 | 1.74 | 1.74 | 0.77 |
| 1.75 | |||
| 1.73 |
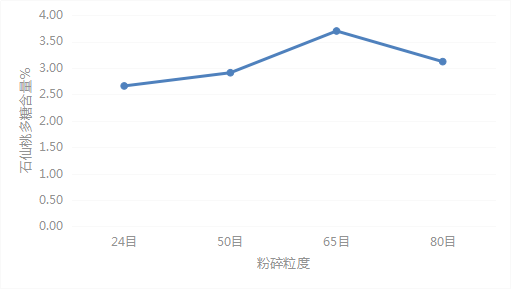
将SXT-12药材粉末分别过24目、50目、65目、80目筛,分别取0.3g,精密称定,加蒸馏水80ml,称重,加热回流2h,并按供试品溶液制备方法项下的方法对提取溶液进行处理,按显色方法项下方法进行显色,紫外分光光度计测定吸光度值。结果显示药材粉碎粒度为65目时,石仙桃多糖提取率最高,故选用粉碎粒度为65目的药材提取石仙桃多糖。见表4、图3。
表4粉碎粒度考察
| 粉碎粒度 | 含量(%) | 平均含量(%) | RSD(%) |
| 24目 | 2.64 | 2.66 | 2.90 |
| 2.74 | |||
| 2.59 | |||
| 50目 | 2.82 | 2.91 | 2.92 |
| 2.98 | |||
| 2.94 | |||
| 65目 | 3.60 | 3.70 | 2.74 |
| 3.69 | |||
| 3.80 | |||
| 80目 | 3.11 | 3.12 | 0.36 |
| 3.13 | |||
| 3.12 |
 |
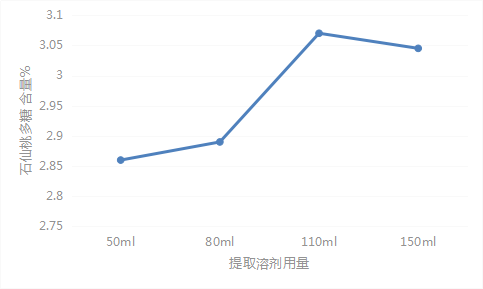
2.2.5.3 溶剂用量考察
分别取过65目SXT-12药材粉末0.3g,精密称定,分别加蒸馏水50 ml、80 ml、110 ml、140ml,称重,加热回流2h,并按供试品溶液制备方法项下的方法对提取溶液进行处理,按显色方法项下方法进行显色,紫外分光光度计测定吸光度值。结果显示加蒸馏水110ml时,石仙桃多糖提取率最高,故加蒸馏水110ml提取石仙桃多糖。见表5、图4。
表5 溶剂用量考察
| 溶剂用量 | 含量(%) | 平均含量(%) | RSD(%) |
| 50ml | 2.90 | 2.86 | 1.03 |
| 2.84 | |||
| 2.84 | |||
| 80ml | 2.90 | 2.89 | 0.71 |
| 2.86 | |||
| 2.89 | |||
| 110ml | 3.08 | 3.08 | 0.83 |
| 3.11 | |||
| 3.06 | |||
| 140ml | 3.01 | 3.03 | 1.36 |
| 3.08 | |||
| 3.00 |
 |
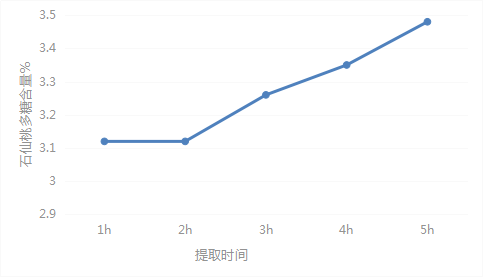
2.2.5.4 提取时间考察
分别取过65目SXT-12药材粉末0.3g,精密称定,加蒸馏水110ml,称重,分别加热回流1.0h、2.0h、3.0h、4.0h、5.0h,并按供试品溶液制备方法项下的方法对提取溶液进行处理,按显色方法项下方法进行显色,紫外分光光度计测定吸光度值。结果显示提取时间为5h时,石仙桃多糖提取率最高,故选用提取时间5h提取石仙桃多糖。见表6、图5。
表6提取时间考察
| 提取时间(h) | 含量(%) | 平均含量(%) | RSD(%) |
| 1 | 3.15 | 3.12 | 1.24 |
| 3.15 | |||
| 3.08 | |||
| 2 | 3.21 | 3.12 | 3.29 |
| 3.01 | |||
| 3.15 | |||
| 3 | 3.21 | 3.26 | 2.38 |
| 3.35 | |||
| 3.21 | |||
| 4 | 3.35 | 3.35 | 0.00 |
| 3.35 | |||
| 3.35 | |||
| 5 | 3.42 | 3.48 | 3.35 |
| 3.62 | |||
| 3.42 |
 |
2.2.6 正交试验方法考察
2.2.6.1 正交试验设计
根据预试验,确定考察粉碎粒度、溶剂用量、提取时间3个因素,每个因素设3个水平。选用L9(34)表安排正交实验。结果见表7、表8。
表7 因素水平表
| 水平 | A | B | C |
| 粉碎粒度 | 溶剂用量 | 提取时间 | |
| 1 | 50目 | 80ml | 3h |
| 2 | 65目 | 110ml | 4h |
| 3 | 80目 | 140ml | 5h |
表8 正交试验结果(n=3)
| 序号 | A | B | C | 含量(%) |
| 1 | 1 | 1 | 1 | 3.1318 |
| 2 | 1 | 2 | 2 | 3.0196 |
| 3 | 1 | 3 | 3 | 2.992 |
| 4 | 2 | 1 | 2 | 3.3862 |
| 5 | 2 | 2 | 3 | 3.3833 |
| 6 | 2 | 3 | 1 | 3.2981 |
| 7 | 3 | 1 | 3 | 3.098 |
| 8 | 3 | 2 | 1 | 3.1234 |
| 9 | 3 | 3 | 2 | 3.0438 |
| K1 | 9.14 | 9.62 | 9.55 | |
| K2 | 10.07 | 9.53 | 9.45 | |
| K3 | 9.27 | 9.33 | 9.47 | |
| R | 0.31 | 0.09 | 0.03 |
根据正交试验结果分析,各因素作用主次为A>B>C;A因素中以k2最大,B因素中以k1最大,C因素中以k1最大。正交试验结果A2B1C2测得含量最高,经过验证性试验,A2B1C1测得石仙桃多糖含量高,故最佳提取工艺选择A2B1C1,粉碎粒度65目、溶剂用量80ml、提取时间3h。结果见表9。
表9 提取工艺比较
| 提取方法 | 含量(%) | A(%) | RSD(%) |
| A2B1C2 | 3.07 | 3.07 | 0.17 |
| 3.07 | |||
| 3.06 | |||
| A2B1C1 | 3.27 | 3.25 | 2.47 |
| 3.33 | |||
| 3.17 |
2.2.7 方法学考察
2.2.7.1 精密度试验
取对照品溶液适量,按显色方法项下方法显色,连续进样测定6次,记录吸光度。结果,D-无水葡萄糖吸光度的RSD=0.43%(n=6),表明仪器精密度良好。见表10。
表10精密度试验结果(n=6)
| 测量次数 | 1 | 2 | 3 | 4 | 5 | 6 | A | RSD(%) |
| 吸光度 | 0.4241 | 0.4241 | 0.4238 | 0.4243 | 0.4289 | 0.4281 | 0.4256 | 0.54 |
2.2.7.2 稳定性试验
精密称取同一批样品适量,按“2.2.6.2”项下方法提取供试品溶液,按供试品溶液制备方法项下方法处理供试品溶液,按显色方法项下方法显色,分别于放置0h、1h、2h、3h、4h、5h进样测定,记录吸光度。结果,D-无水葡萄糖吸光度的RSD= 0.05%(n=9),表明供试品溶液显色在24h内基本稳定。见表11。
表11 稳定性试验结果(n=3)
| 时间 | 0 | 1h | 2h | 4h | 8h | 24h | A | RSD(%) |
| 吸光度 | 0.6806 | 0.6805 | 0.6806 | 0.6803 | 0.6802 | 0.6796 | 0.6803 | 0.05 |
2.2.7.3 重复性试验
精密称取同一批样品适量,按“2.2.6.2”项下方法提取供试品溶液,按供试品溶液制备方法项下方法处理供试品溶液,共6份,按显色方法项下方法显色,进样测定,记录吸光度。结果,D-无水葡萄糖吸光度RSD=0.91%(n=6),表明本方法重复性良好。见表12。
表12 重复性试验结果(n=3)
| 组数 | 1 | 2 | 3 | 4 | 5 | 6 | A | RSD(%) |
| 吸光度 | 0.6754 | 0.6736 | 0.6812 | 0.6736 | 0.6820 | 0.6893 | 0.6792 | 0.91 |
2.2.7.4 加样回收试验
取已知多糖含量的样品6份,每份约0.15g,精密称定,按“2.2.6.2”项下方法提取供试品溶液,按供试品溶液制备方法项下方法处理供试品溶液,按显色方法项下方法显色,测定吸光度。结果,平均加样回收率为98.98%,RSD为2.33%,表明此方法准确性良好。见表13。
表13 加样回收试验结果
| 序号 | 原有量(mg) | 加入量(mg) | 测得量(mg) | 回收率(%) | 平均值(%) | RSD(%) |
| 1 | 0.4689 | 0.4689 | 0.9388 | 100.22 | 98.98 | 2.33 |
| 2 | 0.4688 | 0.4689 | 0.9275 | 97.82 | ||
| 3 | 0.4692 | 0.4689 | 0.9484 | 102.20 | ||
| 4 | 0.4689 | 0.4689 | 0.9278 | 97.87 | ||
| 5 | 0.4688 | 0.4689 | 0.9175 | 95.69 | ||
| 6 | 0.4692 | 0.4689 | 0.9384 | 100.07 |
2.3 含量测定
2.3.1石仙桃不同药用部位多糖含量
文献记载,石仙桃的药用部位为全草或假鳞茎。为考量石仙桃的不同部位的药用价值,发掘不同药用部位,本实验选取石仙桃叶、假鳞茎、根及根茎等药用部位,采取直接晒干的炮制方法供试品溶液制备方法项下方法处理供试品溶液,按显色方法项下方法显色,紫外可见分光光度计测定吸光度值,分别代入标准工作曲线方程计算样品中石仙桃多糖的含量为,结果见表14。
表14 石仙桃不同药用部位多糖含量
| 编号 | 多糖含量(%) | 平均含量(%) | RSD(%) |
| 叶子 | 3.24 | 3.25 | 1.82 |
| 3.32 | |||
| 3.20 | |||
| 假鳞茎 | 14.19 | 14.15 | 0.56 |
| 14.21 | |||
| 14.06 | |||
| 假鳞茎(剪) | 11.84 | 11.94 | 0.78 |
| 11.96 | |||
| 12.03 | |||
| 根及根茎 | 4.23 | 4.14 | 2.14 |
| 4.06 | |||
| 4.14 | |||
| 全草 | 10.96 | 11.12 | 2.15 |
| 11.39 | |||
| 11.00 | |||
| 全草(煮) | 8.18 | 8.03 | 1.87 |
| 8.03 | |||
| 7.88 |
2.3.2 不同批次石仙桃药材中多糖含量
取不同产地、不同季节采收的石仙桃药材,按“2.2.6.2”项下方法提取供试品溶液,按供试品溶液制备方法项下方法处理供试品溶液,按显色方法项下方法显色,紫外可见分光光度计测定吸光度值,分别代入标准工作曲线方程计算样品中石仙桃多糖的含量为3.22%~8.03%,结果见表15。
表15 各批次药材中多糖含量
| 编号 | 多糖含量(%) | 平均含量(%) | RSD(%) |
| SXT-1 | 6.47 | 6.35 | 2.80 |
| 6.14 | |||
| 6.43 | |||
| SXT-2 | 6.47 | 6.35 | 2.80 |
| 6.14 | |||
| 6.43 | |||
| SXT-3 | 6.93 | 6.78 | 2.12 |
| 6.65 | |||
| 6.74 | |||
| SXT-4 | 5.21 | 5.17 | 1.05 |
| 5.20 | |||
| 5.11 | |||
| SXT-5 | 3.21 | 3.22 | 0.43 |
| 3.23 | |||
| 3.21 | |||
| SXT-6 | 8.18 | 8.03 | 1.87 |
| 8.03 | |||
| 7.88 | |||
| SXT-7 | 4.62 | 4.60 | 2.44 |
| 4.48 | |||
| 4.70 | |||
| SXT-8 | 5.66 | 5.72 | 0.93 |
| 5.72 | |||
| 5.77 | |||
| SXT-9 | 4.66 | 4.55 | 2.28 |
| 4.55 | |||
| 4.45 | |||
| SXT-10 | 4.66 | 4.62 | 0.94 |
| 4.62 | |||
| 4.57 | |||
| SXT-11 | 7.96 | 7.96 | 0.10 |
| 7.97 | |||
| 7.96 | |||
| SXT-12 | 3.45 | 3.49 | 1.90 |
| 3.57 | |||
| 3.46 | |||
| SXT-13 | 3.14 | 3.25 | 2.91 |
| 3.31 | |||
| 3.31 | |||
| SXT-14 | 8.15 | 7.98 | 1.83 |
| 7.89 | |||
| 7.89 | |||
| SXT-15 | 4.20 | 4.18 | 0.30 |
| 4.18 | |||
| 4.18 | |||
| SXT-16 | 4.33 | 4.33 | 0.29 |
| 4.34 | |||
| 4.32 |
3 小结与讨论
实验以石仙桃多糖的含量为指标,分别考察了提取方法、溶剂用量、提取时间、药材粉碎粒度等因素。提取方法考察了超声提取法、回流提取法、冷浸法和热浸法;溶剂量分别考察了溶剂水的用量 50 ml、80 ml、110 ml、140ml;回流提取时间分别考察了1h、2h、3h、4h、5h;药材粉碎粒度分别考察了24目、50目、65目、80目。根据单因素试验,对溶剂用量、提取时间、粉碎粒度3个因素进行了正交实验。实验考察结果显示,当称取过65目筛的石仙桃药材粉末0.3g,加入水80 ml,回流提取3h,提取石仙桃多糖的量最高,作为本试验供试品溶液的制备方法。
本实验对石仙桃不同药用部位的多糖进行含量测定,结果表明叶子中多糖的含量最低,其次为根及根茎,含量最高的假鳞茎;药材开水烫过之后多糖的含量降低,剪碎后干燥的假鳞茎中多糖的含量也降低了,可能是由于开水烫后或者药材剪碎后,在干燥过程中,多糖易分解为单糖,不利于多糖的干燥与保存。
本实验对不同产地、不同季节采集的石仙桃药材中的多糖进行了含量测定,结果表明同一产地,春季采收的石仙桃中多糖含量最高,其次为夏季,冬季采收的石仙桃中多糖含量最低;同一季节,来宾市金秀县圣堂山的石仙桃中多糖含量最高,且石仙桃中多糖的含量以广西最高,其次为福建、广东。
此次测定结果为我们提供了药材中多糖含量最高的季节为冬季,且在广西药材的多糖含量多于福建、广东等地,可能于当地的气候条件、温湿度等有一定的关系,这为石仙桃的栽培种植提供一定的参考价值。
参考文献:
[1] 杨海花,翁寒梅,管永光,等.石仙桃多糖的提取工艺及纯化研究[J].食品科学,2009,(02):130-133.
[2] 国家中医药管理局《中华本草》编委会编.中华本草[M].上海:上海科学技术出版社.1999: 748-750.
[3] 江苏新医学院.中药大辞典[M].上海:上海人民出版社,2004.
[4] 王晓燕,黎理,朱华.石仙桃研究进展[J]. 亚太传统医药,2016,01:42-44.
[5] 刘莹,张云梅,金永,等.石仙桃属植物化学成分及药理活性研究进展[J].时珍国医国药,2007,07: 1631-1633.
[6] 翁水旺.石仙桃的研究进展[J].中国现代中药,2006,06:35-36.
[7] 刘建新,周青,连其深.石仙桃对中枢神经系统抑制作用[J].赣南医学院学报,2004,02:119-121.
[8] 杨素雄,姜家康,迟文成,隋雨桐.石仙桃的药理进展[J].世界最新医学信息文摘,2016,69: 67-68+70.
[9] 申利红,王建森,李雅,等.植物多糖的研究及应用进展[J].中国农学通报,2011,(02):349-352.
[10] 朱华,傅鹏,苏健主编. 壮药材石仙桃、昂天莲的研究[M].南宁:广西科技出版社,2017.132.
[11] 罗毅,潘细贵,刘刚,等.苯酚-硫酸法测定多糖含量显色方式的优选[J].中国中医药信息杂志, 2005,01:45-46.
[12] 苏玉顺,李艳君,赵方振,等.紫外-可见分光光度法在植物多糖含量测定中的应用[J].光谱实验室, 2011,03:1101-1107.

单点登录
账号密码登录