中药学研究生联合培养基地课程案例库
《细胞信号转导与调控》 酶偶联受体介导的信号转导途径——以酪氨酸激酶抑制剂为例
《细胞信号转导与调控》
酶偶联受体介导的信号转导途径——以酪氨酸激酶抑制剂为例
首页注释:唐慧勤,广西中医药大学,通过上市药物小分子靶向药物的开发研究过程,深刻理解和掌握细胞信号与调控过程,通过分子层面学习药物的作用机制。本案例来源于文献报道,真实可靠。
中文摘要及关键词:生物体内的细胞间通讯是实现生命活动的基础。细胞信号传导是一种通过生物分子进行信息交流的过程,包括上下游信息传递细胞内信息传递等多个方面。信号转导的机制和调控是细胞信号传导研究的基础和核心。亲水性的化学信号分子(包括神经递质、蛋白激素、生长因子等)不能直接进入细胞,只能通过膜表面的特异性的受体传递信号,使靶细胞产生效应。受体酪氨酸蛋白激酶(TPK)介导的信号转导途径就属于上述膜表面受体介导的信号转导。TPK是催化蛋白质中酪氨酸残基磷酸化的酶,在细胞的生长,增殖,分化等过程中起重要作用,并与肿瘤的发生有关系.
关键词:细胞信号;肿瘤;酪氨酸激酶
引言或开头:细胞信号转导是指细胞外因子通过与受体(膜受体或核受体)结合,引发细胞内的一系列生物化学反应以及蛋白间相互作用,直至细胞生理反应所需基因开始表达、各种生物学效应形成的过程。现已知道,细胞内存在着多种信号转导方式和途径,各种方式和途径间又有多个层次的交叉调控,是一个十分复杂的网络系统。在这一系统中,细胞或者识别与之相接触的细胞,或者识别周围环境中存在的各种信号(来自于周围或远距离的细胞),并将其转变为细胞内各种分子功能上的变化,从而改变细胞内的某些代谢过程,影响细胞的生长速度,甚至诱导细胞的死亡。所以,阐明细胞信号转导的机理就意味着认清细胞在整个生命过程中的增殖、分化、代谢及死亡等诸方面的表现和调控方式,进而理解机体生长、发育和代谢的调控机理。
背景介绍:科学家们分离或改良设计其他多种小分子药物,用于控制肿瘤细胞中MAPK 和 PI3K/Aktcascade 等通路的异常。Trastuzumab(群司珠单抗;又称Heceptine,赫赛汀)是受体型酪氨酸激酶(receptor tyrosine kinase,RTK)HER2 的单克降抗体,于1998 年被 FDA 批准用于治疗乳腺癌,是新一代抗肿瘤药物的主要代表。Trastuzumab 与RTK 的细胞外域结合,可诱导受体内化,引起 HER2 下调,使细胞周期阻滞,使与抗体依赖的细胞毒性作用受抑制。同时,Trastuzumab还可经受体作用阻滞 HER2 的过度活化。临床试验显示,Trastuzumab 对受过与未受过治疗的转移性乳腺癌患者均有很好的好效。与单独应用普通化疗的相比,联合应用 Trastuzumab 可使 HER2过表达患者的生存期显着延长。ABL(abelsonleukaemiaviraloncogene)是一种活性酪氨酸激酶蛋白,可驱动未成熟骨髓细胞增殖。其抑制ST1-571(lmatinib or Gleevec) 可抑制该激酶,进而通过抑制ABL信号转导相关下游蛋白酪氨酸磷酸化而抑制表BCR-ABL的细胞。研究已证实Imatinib(伊马替尼;又称Gleevec,格列卫)在治疗慢性髓细胞性白血病(chronic myeloid leukemia,CML)中有显著疗效,于2001年被批准用于干扰素-α治疗失败的CML患者。此外,Imatinib还具有抗c-kit和血小板源性生长因子受体的酪氨酸激酶活性。
内容:细胞应答胞外因子刺激首先是通过该因子结合到细胞表面受体,触发细胞内一系列生化级联反应,从而调节靶蛋白的功能和表达。在这一连续的多步途径中,蛋白磷酸化是一种主要方式。蛋白激酶是一种能够将ATP的磷酸基团转移到蛋自上的酶,组成了癌基因产物的很大一部分,在信号转导的几个不同水平上发挥作用。通过对蛋白激酶、生长因子受体和癌基因进行序列比较,确定相对保守的酪氨酸激酶催化功能域。根据这段序列,人们发现许多癌基因含有酪氨酸激酶域。正常的生长因子受体酪氨酸激酶只有当与相应的生长因子结合、形成生长因子受体的二聚体,并相互磷酸化对方后,才有活性,而很多癌基因同源产物因配基结合区的缺失或其他突变,而具有组成型激酶活性,不再受生长因子的调控。
劳氏肉瘤病毒(Rous sarcoma virus,RSV)的src癌基因编码个60x103的蛋白,是发现的可磷酸化酪氢酸残基的第一种蛋白激酶、细胞内 Src蛋白的第527位酪氨酸通常由于做其他酪氨酸激酶(如Csk)磷酸化,而没有活性,特定的磷酸酯酶能催化该酪氨酸脱磷酸化,从而激活Src。RSV的sre基因编码的蛋白丢失了第527位酪氨酸在内的C端18个氨基酸,因此具有组成型活性。
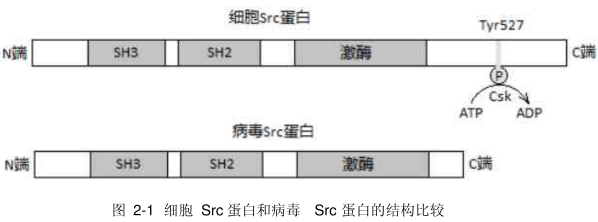
目前已上市或临床研究的酪氨酸激酶抑制剂的结构较多,大多数都同时含有苯环和含氮杂环,这类药物可大致分为喹唑啉类、喹啉类、吲哚类、吲唑类、氨基嘧啶类、哒嗪类及芳基脲类。甲磺酸伊马替尼(imatinib mesylate,14-80)是由瑞士诺华公司研发的2-苯氨基嘧啶类的Bcr-Abl酪氨酸激酶抑制剂,于2001年首次在美国上市。该产品通过竞争结合ATP位点,特异性阻止酪氨酸激酶受体自身磷酸化,影响细胞信号转导,抑制细胞增殖,对白血病患者的疗效优于已有的化疗方法和骨髓移植法。
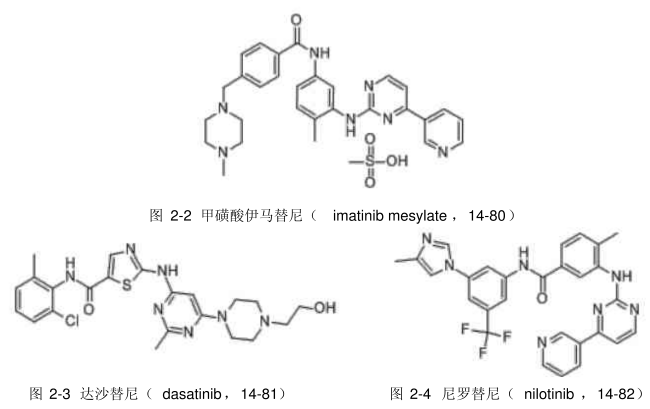
研究已证实伊马替尼(也称 Gleevec)在治疗慢性粒细胞白血病(chronic
myeloid leukemia,CML)中有显著疗效,于2001年被批准用于IFN-a治疗失败的CML患者。此外,伊马替尼还具有抗干细胞因子受体c-kit和血小板源生长因子(platelet derived growth factor,PDGF)受体的酪氨酸激酶活性。但是在治疗中发现,一些患者逐渐出现了对伊马替尼的耐药性。针对这种耐药性,近年来人们开发了第二代Bcr-Ab1酪氨酸激酶抑制剂,如达沙替尼(dasatinib,14-81)和尼罗替尼(nilotinib,14-82),在临床上可用于治疗伊马替尼不能耐受的成人慢性髓细胞和费城染色体阳性的急性淋巴细胞白血病。
小结:虽然靶向药物得了巨大成功,但耐药性问题仍不可避免。例如由于酪氨酸激酶的点突变,患者可产生对 Imatinib 的抵抗。该问题可通过联合应用针对不同分子靶标的药物来解决。鉴于肿瘤是多基因参与的多阶段性复杂疾病,多靶点治疗药物的开发是更有前景的策略。Sorafenib 正是这样一种新型多靶点抗癌药物,其不仅可通过直接阻滞 RAF/ MEK/ERK信号转导通路,还能通过抑制 VEGF 和 PDGF 阻止肿瘤血管生长而抑制肿瘤的进展。根据Ⅲ期临床试验结果,Sorafenib 最近已被FDA批准用于治疗晚期肾细胞癌。Sunitinib(Sutent SU11248)是FDA批准的另一种小分子药物。它通过抑制VEGF-R2、R3、R1、DGFR-B、KIT、LT-3.RET及相关信号通路而对肾细胞癌、胃肠间质瘤、神经内分泌肿瘤、肉瘤、甲状腺癌、黑素瘤、乳癌和非小细胞肺癌产生抗癌效应。
案例教学指导手册
《调控酪氨酸激酶对细胞信号的影响》
一、教学目的与用途
1.适用课程:《细胞信号转导与调控》
2.适用专业:中药学专业硕士
3.教学目标:掌握调控酪氨酸激酶对细胞信号的影响。
二、 教学内容:
1.细胞通讯的分子基础
2.主要细胞信号转导途径
3.细胞信号转导过程的基本规律
4.酪氨酸激酶在信号转导途径中的功能
5.细胞信号转导研究在医药学界的意义
三、启发思考题:
1.肿瘤发生、发展相关的重要信号通路有哪些?请归纳。
2.病毒与肿瘤有什么样的关系?
四、建议课堂计划:
本教学案例设计选取真实药物开发案例,将治疗勃起功能障碍的药物西地那非的开发过程真实还原到课堂教学过程中,让学生在课堂中彷参与药物的筛选、优化过程,从专业型硕士研究生的思维进行药物作用机制的分析,从而掌握相关的知识点。过程如下:
1.课前教师可通过网络教学平台向学生发布学习任务,要求学生首先课前预习课本《细胞信号转导与调控》的概论部分,其次通过查阅文献,以思维导图的形式归纳细胞信号转导的途径,尤其以酪氨酸蛋白激酶( TPK)信号途径做重点详细的描述。
2.课中,教师授课时可使用配套的案例幻灯片或相关视频进行教学,第一部分为基础知识学习部分,以展示和问题为主导,帮助学生建立细胞信号转导的基本知识体系,引导学生思考细胞信号的改变对机体生理病理的影响,由老师解读细胞信号调控的意义。第二部展示小分子靶向药物酪氨酸激酶抑制剂的背景与过程,并提出问题引发同学们思考:①肿瘤发生、发展相关的重要信号通路有哪些?请归纳。②病毒与肿瘤有什么样的关系?随后学生分组讨论分析,对问题作出解答。由老师对学生的答案做出评价,并总结酪氨酸激酶对细胞信号转导途径影响的意义。第三部分为案例延伸讨论与答疑:①抗癌药产生耐药的主要机制是什么?②如何延缓耐药的产生和增强药物疗效?引导学生了解更多的抗癌药物。
参考文献:
1.Kumar R,Shepard HM,Mendelsnhn J.Regulation ofphesphorylation 0f the c-erbB-2/HER2 gene product by amoneelonal antibody and serum growth factor(s)in human mammary carcinoma cells[J].Mol Cell Bid,1991,11(2):979-986.
2.Molina MA,Codony-Servat J,Albandl J,et al.Trastuzumab (herceptin), a humanized anti-Her2 receptor monselonal antibody,inhibits basal and activated Her2 ectedomain cleavage in breast cancer cem[J].Cancer Res,2001,61(12):4744-4749.
3.Cobleigh MA, Vogel CL, Tripathy D,et al.Multinational study of the efficacy and safety 0f humanized anti-HER2 moneelonal antibody in women who have HER2--overexpressing metastatic breast cancer that has progressed after chemotherapy for metastatic disease[J].J Clin Oncol,1999,17(9):2639-2648.
4.Vogel CL,Cobleigh MA,Tripathy D,et al.Efficacy and safety of trastuzumab as a single agent in first-line treatment of HER2-over-expressing metastatic breast cancer[J].J Clin Oncol.2002,20(3):719-726.
5.Slamon DJ, Leyhnddones B, Shal S, et al.Use of chemotherapy plus a monoclonal antibody against HER2 for metastatic breast cancer that overexpresses HER2[J].N Engl J Med,2001,344(11):783-792.
6.Muller AJ, Young JC, Pendergast AM, et al.BCR first exon sequences specifically activate the BCR/ABL tyrosine kinase oncogene of Philadelphia chromosome-positive human leukemias[J].Mol Cell Bid,1991,ll(4):1785-1792.
7.Deininger MW,Goldman JM,Melo JV.The molecular biology of chronic myeloid leukemia[J].Blood,2000,96(10):3343-3356.
8.Dciningcr MW, Goldman JM, Lydon N, et al.The tyrosine kinase inhibitor CGP57148B selectively inhibits the growth of BCR-ABL-positive cells[J].Blood,1997,90(9):3691-3698.
9.Dmker BJ,Sawyers CL,Kantarjian H , et al.Activity of a specific inhibitor of the BCR-ABL tyrosine kinase in the blast crisis 0f chronic myeloid leukemia and acute lymphohlastie leukemia with the Philadelphia chromosome[J].N Engl J Med,2001,344(14):1038-1042.
10.Kantsrjian HM,Cortes JE, O’Brien S, et al.Long—term survival benefit and improved complete cytngermtie and molecular response rates with imatinib mesylate in Philadelphia chromosome—positive chronic·phase chronic myeloid leukemia after failure of interferon· alpha[J].Blood,2004,104(7):1979-1988.
11.Druker BJ, Lydon NB.Lessons learned from the development of an ABL tyrosine kinase inhibitor for chronic myelogenons leuksemia, et al.J Clin Invest,2000,105(1):3-7.
12.Heinrieh MC,Blanke CD,Druker BJ, et al.Inhibition of KIT tyrosine kinase activity:a novel moleeulas approach to the treatment of KIT-positive malignancies[J].J Clin Oncmi,2002,20(6):1692-1703.
13.Silvestri GA,Rivem MP.Targeted therapy for the treatment of advanced non-small cell lung cancer:a review of the epidermal growth factor receptor antagonists[J].Chest,2005,128(6):3975-3984.
14.Cohen EE, Kane MA, List MA, et al.Phase II trial of gefitinib 250 mg daily in patients with recurrent and/or metastatic squamous cell carcinoma of the head and neck[J].Clin Cancer Res,2005,11(23):8418-8424.
15.Gorre ME, Mohammed M, Ellwoed K, et al.Clinical resistance to STI-571 cancer therapy caused by BCRABL gene mutation or amplifieation[J].Science,2001,293(5531):876-880.
16.Adjei AA, Molina JR, Mandrekar SJ, et al.Phase I trial of sorafenib in combination with gefitinib in patients with refractory or recurrent non-small cell lung cancer[J].Clin Cancer Res,2007,13(9):2684-2691.
17.Walter P,, Dumez H, Schoffski P.Sunitinib and hypothyroidism[J].N Engl J Med,2007,356(15):1580.
