《分析化学》实验教学大纲
课程编号:BJ0205001S
课程类别:专业基础课
课程性质:必修课
实验学时:34
适用专业:中药学专业
开课单位、教研室:药学院 分析化学教研室
实验项目总数:6,其中验证性:1 ,综合性:4,设计性:1
实验目的与要求
分析化学是一门实践性很强的学科,通过实验课和理论课的相互配合,可巩固、加深学生对分析化学基本理论的理解,并熟练掌握分析化学的基本操作技能,培养学生动手能力和认真观察、积极思考、实事求是、理论联系实际的解决问题的能力,为今后的工作和科研打下良好的基础。
实验教学目标与内容
实验一 分析化学基本操作练习
【实验目的】
1. 掌握电子天平的使用方法。
2. 掌握滴定管、容量瓶、移液管的操作方法和使用规则。
【实验内容】
一、电子天平的使用
讲解介绍电子天平的构造和原理,使用方法和规则,然后学生进行实验操作:
1. 称前检查;
2. 电子天平调水平;
3. 取洁净称量瓶,置于天平称量盘中央,记录读数,则为称量瓶重量;
4. 称后检查。
二、讲解并示范容量器皿的操作方法和注意事项,后让学生实验操作:
1.滴定管、移液管、容量瓶的洗涤
要求洗涤后的器皿内壁透明清洁,没有条纹,不附水珠。
2.用水练习滴定管、容量瓶、移液管的使用
(1)检查滴定管是否漏水,练习赶去尖嘴附近的气泡,并练习滴定操作和准确读数。
(2)练习用玻棒引流将水注入容量瓶,后用吸管慢慢地加水至标线,颠倒摇动容量瓶。
(3)练习用移液管抽吸溶液,并准确调液面至刻线,然后将溶液转至锥形瓶中。
实验二 柠檬酸含量的测定
【实验目的】
1.学会配制标准溶液并标定其准确浓度。
2.掌握滴定器皿的使用方法。
3.掌握滴定终点的判断。
4.掌握柠檬酸测定的原理和目的。
5.掌握多元酸的分步滴定条件。
【实验内容】
一、氢氧化钠标准溶液的配制与标定
1.称取氢氧化钠120g,加蒸馏水100ml于塑料瓶中,得氢氧化钠饱和水溶液。
2.吸取NaOH饱和溶液2.8ml于500ml细口瓶中,加500ml蒸馏水稀释,摇匀贴上标签。
3.精密称取5.0-5.5g干燥至恒重的邻苯二甲酸氢钾,溶解后于250ml容量瓶中定容。
4.取20.00ml邻苯二甲酸氢钾溶液三份,用NaOH标准溶液滴至酚酞呈浅红色为终点。
5.结果计算:
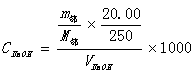
二、柠檬酸的含量测定
1.精密称取1.7-1.8g柠檬酸溶解后于250ml容量瓶中定容。
2.平行移取上述溶液20.00ml三份,加酚酞指示剂后,以NaOH标准溶液滴至粉红色终点。
3.结果计算:
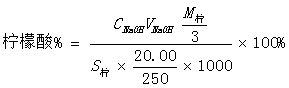
实验三 水硬度的测定
【实验目的】
1.掌握EDTA标准溶液的配制和标定方法。
2.掌握络合滴定法测定水硬度的原理和方法。
3.了解水硬度的表示方法及其计算。
【实验内容】
一、EDTA标准溶液的配制和标定
1.称取EDTA-2Na�2H2O 8.5g,配成500ml溶液。
2.精密称取干燥后CaCO3 1.2-1.3g,湿润后以少量1︰1HCl溶解后于250ml容量瓶中定容。
3.取上述溶液20.00ml三份,加入20ml pH=10的氨性缓冲液和3滴K-B指示剂,用EDTA溶液滴至紫红色变为蓝绿色为终点。
4.结果计算:
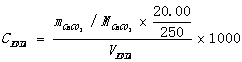
二、水硬度的测定
1.取0.05mol/LEDTA标准溶液20.00ml,配成100ml溶液。
2.量取100.0ml水样,加入氨性缓冲液5ml和少量铬黑T指示剂,用EDTA滴定至酒红色变为纯兰色为终点。
3.结果计算:
![]()
实验四 葡萄糖注射液中葡萄糖含量的测定
【实验目的】
1.掌握Na2S2O3标准溶液的配制方法。
2.了解碘量法的操作过程。
3.了解和掌握碘量法测定葡萄糖的条件和方法。
【实验内容】
1.Na2S2O3标准溶液的配制与标定
(1)取0.1g Na2CO3溶于500ml新沸放冷蒸馏水中,再加入12.4g Na2S2O3�5H2O,置于棕色试剂瓶中,放置两周。
(2)精密称取干燥后的K2Cr2O7 1.1-1.4g,配成250ml溶液。
(3)量取K2Cr2O7溶液20.00ml三份,于碘量瓶中加入KI 1g 和2N HCl 15ml,暗处放5分钟后加入20ml水稀释,用Na2S2O3滴定至淡黄绿色后加入淀粉溶液3ml,继续滴定至兰色消失,为终点。
(4)结果计算:

2.葡萄糖含量的测定
(1)取葡萄糖注射液2.00ml,于碘量瓶中加入0.05mol/L I2液20.00ml,边振摇边滴加0.05mol/L NaOH溶液40ml,暗处放10分钟,然后加入0.5mol/L H2SO46ml,用0.1mol/L Na2S2O3滴定至淡黄色,加淀粉指示剂2ml,滴至兰色消失为终点。
(2)配制碘液:称碘3.2g,碘化钾8g,加10ml水溶解后加浓盐酸两滴,于棕色瓶中再加240ml水。
(3)取上述碘液20.00ml,按步骤1做空白实验。
(4)结果计算:
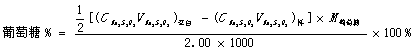
实验五 双氧水中H2O2含量的测定
【实验目的】
1.掌握KMnO4标准溶液的配制、标定、保存方法。
2.掌握用KMnO4法测定H2O2含量的方法。
【实验内容】
1.KMnO4标准溶液的配制与标定
(1)取KMnO40.8g,配成250ml溶液,于棕色瓶中暗放7-10天,过滤于另一棕色瓶中存放。
(2)准确称取(减量法)Na2C2O4 0.14—0.16g三份于锥形瓶中,加20ml水溶解后加入KMnO4溶液约15ml,褪色后,加热至65℃,继续滴至呈粉红色为终点。
(3)结果计算:
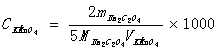
2.双氧水中H2O2含量的测定
(1)取3%双氧水5.00ml,配成100.00ml溶液。
(2)取20.00ml上述溶液加入1mol/L H2SO4 20ml,用0.02mol/L KMnO4滴定至粉红色为终点。
(3)结果计算:
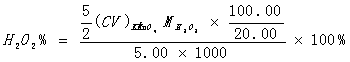
实验六 中药文蛤中碳酸钙含量的测定
【实验目的】
设计实验测定中药文蛤中CaCO3的含量。
【实验内容】
实验步骤自行设计
实验主要仪器设备试剂
1.仪器:
托盘天平;分析天平;容量瓶(250mL,100 mL);移液管(100 mL,20mL,5.00 mL,2.00 mL);酸碱两用滴定管(50mL),锥形瓶(250mL),碘量瓶(250mL),量筒(50mL),试剂瓶,小烧杯,滴管,表面皿,硬质玻璃瓶或聚乙烯塑料瓶,棕色试剂瓶,垂熔玻璃漏斗,温度计,恒温水浴槽。
2.试剂
氢氧化钠(AR);邻苯二甲酸氢钾(GR,于105~110℃干燥一小时后,放 入干燥器中备用);酚酞指示剂(0.2%乙醇溶液),枸橼酸试样,EDTA二钠盐,碳酸钙(基准试剂,于120℃干燥2小时,放干燥器内备用),盐酸溶液(6 mol/L),氨性缓冲溶液(pH=10),K-B指示剂,铬黑T指示剂,碳酸钠,硫代硫酸钠(Na2S2O3�5H2O),重铬酸钾(GR,于120℃干燥至恒重,放干燥器内备用),碘化钾,盐酸溶液(2 mol/L),淀粉指示剂,碘,葡萄糖注射液(5%),氢氧化钠溶液(0.1mol/L),硫酸溶液(0.5mol/L),0.1mol/LNa2S2O3标准溶液,0.05mol/L碘标准溶液,淀粉指示剂,高锰酸钾,草酸钠(GR,于105℃干燥至恒重,放干燥器内备用),硫酸溶液(3mol/L),双氧水(30%和3%),硫酸溶液(1mol/L),0.02mol/L高锰酸钾标准溶液。
实验考核方式
实验成绩的评定包括:①预习(占10%);②原始记录(占10%);③实验操作技术(占30%);④纪律与卫生(占10%);⑤结果报告(占40%)。实验指导教师根据以上5点评定成绩。
实验项目汇总及课时分配
|
序号 |
实验项目名称 |
计划学时 |
实验类型 |
每组人数 |
项目 类别 |
|||
|
验证性 |
综合性 |
设计性 |
|
必做 |
选做 |
|||
|
1 |
分析化学基本操作练习 |
4 |
√ |
|
|
16 |
√ |
|
|
2 |
柠檬酸含量的测定 |
6 |
|
√ |
|
16 |
√ |
|
|
3 |
水硬度的测定 |
6 |
|
√ |
|
16 |
√ |
|
|
4 |
葡萄糖注射液中葡萄糖含量的测定 |
6 |
|
√ |
|
16 |
√ |
|
|
5 |
双氧水中H2O2含量的测定 |
6 |
|
√ |
|
16 |
√ |
|
|
6 |
中药文蛤中碳酸钙含量的测定 |
6 |
|
|
√ |
16 |
√ |
|
|
合计数 |
34 |
2 |
4 |
1 |
|
7 |
0 |
|
